La spettroscopia e la necessità di altri numeri quantici
L’atomo di Bohr si rivelò inadeguato a descrivere atomi aventi più di un elettrone: i loro spettri possedevano raggruppamenti di righe vicinissime tra di loro che non erano giustificabili con il modello di Bohr.
Nel 1915 Sommerfeld decise di applicare agli elettroni le leggi di Keplero: l’elettrone si muoveva su orbite ellittiche e il nucleo era uno dei due fuochi. 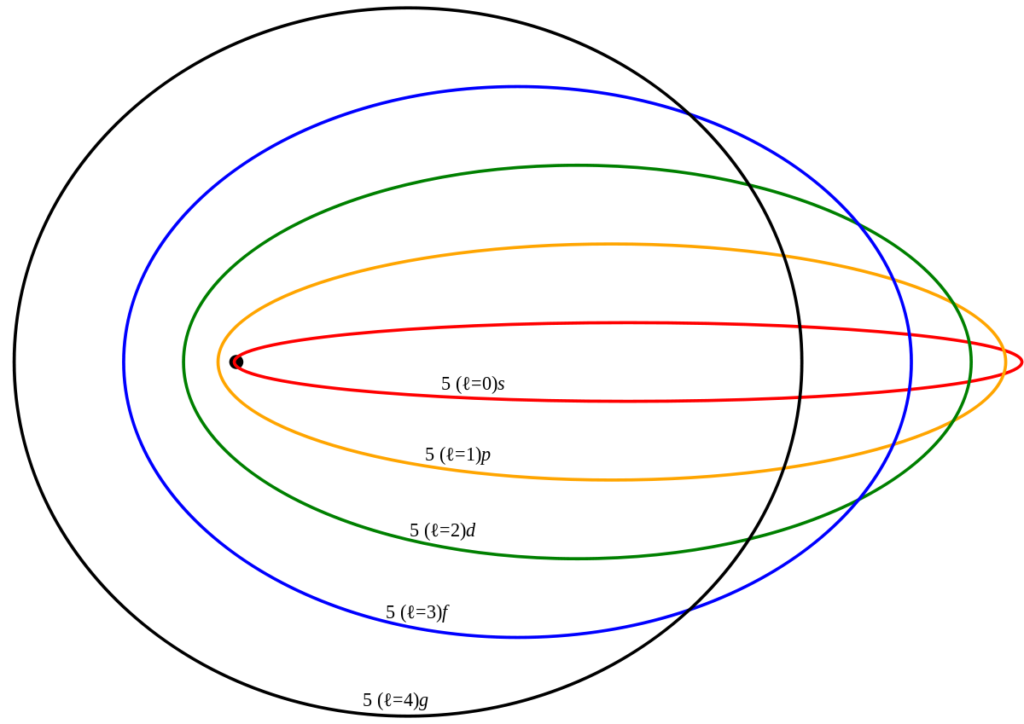
Mentre per descrivere una circonferenza bastava il solo raggio, per descrivere un’ellisse servivano due parametri, come ad esempio i due assi. Per questo motivo venne introdotto un secondo numero quantico l, che insieme con n, serviva a quantizzare gli assi dell’ellisse. n quantizzava principalmente l’energia e l , che poteva assumere solo i valori compresi tra 0 e , l’eccentricità dell’ellisse, cioè la sua forma. In questo modo, per ogni n era prevista una molteplicità di valori dell’energia (in base a l ) che aumentava il numero di salti possibili (salti che risultavano vicinissimi a parità di n).
L’introduzione dei sottolivelli, dovuta a Sommerfeld, permise di spiegare solo in parte la struttura fine dello spettro: il numero di sottolivelli prodotto dalle orbite ellittiche non era ancora sufficiente a giustificare la “finezza” dello spettro.
Nel 1820 Ampère aveva previsto che una spira percorsa da corrente elettrica produceva un momento magnetico che dipendeva dal suo momento angolare. Similmente accadeva per un’orbita elettronica. Essendo il momento angolare quantizzato, così era anche il momento magnetico. 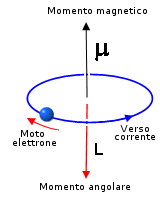 Sotto l’azione di un campo magnetico esterno (nel caso atomico tale campo magnetico era prodotto dal nucleo carico positivamente), una stessa orbita può orientare il suo vettore momento magnetico solo in alcune direzioni diversificando il suo contributo energetico e aumentando, quindi, il numero dei sottolivelli. Per descrivere il numero delle direzioni possibili fu introdotto un terzo numero quantico m , detto numero quantico magnetico, che poteva assumere valori solo tra
Sotto l’azione di un campo magnetico esterno (nel caso atomico tale campo magnetico era prodotto dal nucleo carico positivamente), una stessa orbita può orientare il suo vettore momento magnetico solo in alcune direzioni diversificando il suo contributo energetico e aumentando, quindi, il numero dei sottolivelli. Per descrivere il numero delle direzioni possibili fu introdotto un terzo numero quantico m , detto numero quantico magnetico, che poteva assumere valori solo tra e
. Il numero degli m associati a un certo sottolivello l indicava in quanti modi il tipo di orbita poteva orientarsi nello spazio: ad esempio, per
si aveva
e ciò indicava che l’orbita ellittica poteva orientarsi in 3 modi diversi producendo 3 sottolivelli a differente energia.
Quindi, mentre il numero quantico secondario dava informazioni sulla forma dell’orbita descritta dall’elettrone, il numero quantico magnetico indicava il numero di orbite presenti in un dato livello energetico principale.
Nonostante l’introduzione di un terzo numero quantico, non si riusciva ancora a spiegare il fatto che nello spettro di alcuni metalli pesanti era presente un numero di righe superiore a quello previsto dal modello di Sommerfeld. La giustificazione teorica della presenza di queste righe spettrali fu data nel 1926 dai fisici Uhlenbeck e Abraham: secondo loro l’elettrone, oltre a essere caratterizzato dalla rivoluzione intorno al nucleo, era caratterizzato anche da una rotazione su se stesso. In tal modo, essendo dotato di carica, l’elettrone creava un suo campo magnetico. 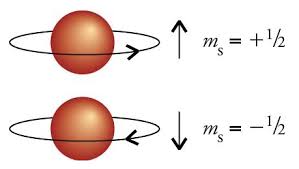 Poiché la particella poteva girare su se stessa in verso orario o antiorario, il quarto numero introdotto per quantizzare la rotazione, detto numero quantico magnetico di spin, assumeva solo due valori:
Poiché la particella poteva girare su se stessa in verso orario o antiorario, il quarto numero introdotto per quantizzare la rotazione, detto numero quantico magnetico di spin, assumeva solo due valori: .
Il modello atomico di Bohr – Sommerfeld non era soddisfacente per i fisici poiché era un ibrido tra un modello classico e un modello quantistico. Inoltre, nel momento in cui si consideravano atomi con tanti elettroni, non si capiva quale dovesse essere la loro distribuzione dal momento che non si poteva più trascurare la loro interazione reciproca. Se non avessero interagito reciprocamente, gli elettroni sarebbero stati tutti equivalenti e si sarebbero sistemati spontaneamente sul livello a minor contenuto energetico. Ciò non era possibile: la spettroscopia aveva già mostrato che anche nello stato fondamentale (quello a minor contenuto energetico) gli elettroni erano distribuiti su livelli energetici differenti.
Il problema fu risolto da Pauli nel 1925: secondo il fisico austriaco, gli elettroni dovevano avere spin opposti per poter stare  vicini, similmente a quanto accadeva per i magneti. Due elettroni erano vicini se occupavano la stessa orbita, ma ciò voleva dire che su una stessa orbita non potevano stare più di due elettroni. Tale principio, noto come principio di esclusione di Pauli, consentiva anche di stabilire quanti elettroni potessero stare, al massimo, su ciascun livello energetico. Il numero massimo di elettroni per livello si ricavava semplicemente dall’espressione
vicini, similmente a quanto accadeva per i magneti. Due elettroni erano vicini se occupavano la stessa orbita, ma ciò voleva dire che su una stessa orbita non potevano stare più di due elettroni. Tale principio, noto come principio di esclusione di Pauli, consentiva anche di stabilire quanti elettroni potessero stare, al massimo, su ciascun livello energetico. Il numero massimo di elettroni per livello si ricavava semplicemente dall’espressione . Detto altrimenti, il principio di esclusione di Pauli asseriva che in un atomo non potevano esistere due elettroni aventi i quattro numeri quantici uguali.


